Чтобы от него плясать.Z_h_e, 04 Авг. 18, 01:04На этом этапе размышлений определение кипения, думаю, нам бесполезно. Вон некоторые "физики" для себя определили, что любое испарение -это кипение, ибо кипение- это испарение.
Кипит - не кипит
Кипит - не кипит
- Кипит
22 - Не кипит
46 - Кипит только в ЭМУ. На пленке - не кипит
8 - Кипит только на нижних ТТ. На верхних - НЕ кипит
1 - Не знаю :-(
20 - Всё сложно %-(
24 - Тему прикрыть? Янна наказать?
4
Всего голосов: 124
ВОблин
Доцент
Самара
1.9K 672


Отв.440 04 Авг. 18, 01:12
Z_h_e
Доцент
г. Чайковский
1.1K 317


Отв.441 04 Авг. 18, 01:25 (через 13 мин)
Без однозначной терминологии смысла дискутировать нет.
К примеру, есть однозначное определение параллельных прямых. "Вдруг", некие дядьки стали утверждать что якобы параллельные прямые пересекаются. А вот и не хрена, если они смогли и доказали что все прямые пересекаются, то они доказали что параллельных прямых не существует, а не то что параллельные прямые пересеклись. Потому что согласно определению они не пересекаются.
Тоже самое с кипением. Где есть его однозначная трактовка? Как килограмм в Париже, вещь условная, но реперная для всех.
К примеру, есть однозначное определение параллельных прямых. "Вдруг", некие дядьки стали утверждать что якобы параллельные прямые пересекаются. А вот и не хрена, если они смогли и доказали что все прямые пересекаются, то они доказали что параллельных прямых не существует, а не то что параллельные прямые пересеклись. Потому что согласно определению они не пересекаются.
Тоже самое с кипением. Где есть его однозначная трактовка? Как килограмм в Париже, вещь условная, но реперная для всех.
okun
пользователь
Тольятти
6.8K 2.5K 3


Отв.442 04 Авг. 18, 07:02
Возьмем сковородку с водой разогреем ее до кипения воды затем выключим газ и как Костя mekkaod, будем нагревать уже сверху через (пленку воды). закипит?ВОблин, 04 Авг. 18, 00:48
Не та модель. Я ранее выкладывал ролик, где капля воды подогреваемая паром кипела. Там нагрев шел через пленку, но снизу. Как в колонне.
Kotische
Академик
Саратов
8.2K 2.6K


 Отв.443 04 Авг. 18, 09:04
Отв.443 04 Авг. 18, 09:04
В пленочном режиме — не кипит.В пленочном СКОРЕЕ ВСЕГО не кипит, т.к. очень сложно возниунуть условиям кипения.
В эмульгационном — кипит.игорь223, 03 Авг. 18, 20:38
В эмульгационном то же НЕ ФАКТ что кипит, но предположить наличие кипения здесь гораздо проще.
Kotische
Академик
Саратов
8.2K 2.6K


 Отв.444 04 Авг. 18, 09:12 (через 9 мин)
Отв.444 04 Авг. 18, 09:12 (через 9 мин)
Что нам дает манипуляция терминамиАнтел, 03 Авг. 18, 22:04Всего лишь ПОНИМАНИЕ происходящих процессов.
Гнать самогон мог даже неандерталец без всякого физического образования. Понимание того как работает природа позволяет строить правильные предположения и модели и теории которые затем распространять на другие явления.
Например понять что получение из браги спирта и получение жидкого азота из воздуха - процессы в чем то аналогичные.
Этим "какие то там физики" и отличаются от неандертальцев, списывающих всю на божественный промысел и вселяющихся в брагу духов алкоголя.
mekkaod
Научный сотрудник
Одесса
3.4K 2.3K


Отв.446 04 Авг. 18, 09:42 (через 27 мин)
ибо кипение- это испарениеВОблин, 04 Авг. 18, 01:12замечу, что своими глазами видел как в стеклянной колбе с откаченным воздухом происходило кипение воды, но при этом пара небыло.
само кипение достигалось, рукоположением на колбу )))
alexeyT
Профессор
москва - деревня под Обнинском
24.1K 9.2K
 Отв.447 04 Авг. 18, 09:54 (через 13 мин)
Отв.447 04 Авг. 18, 09:54 (через 13 мин)
Kotische, ну да... труба, заполненная эмульсией, кипит на каждом этаже при своей Т
Снизу 100*с, сверху 78*с
Получишь при кипении Одну честную ТТ
Снизу 100*с, сверху 78*с
Получишь при кипении Одну честную ТТ
ВОблин
Доцент
Самара
1.9K 672


Отв.448 04 Авг. 18, 10:03 (через 10 мин)
Не та модель.okun, 04 Авг. 18, 07:02согласен, в принципе в обыкновенном пвк наверно наглядней даже.
Вот кстати видосKotische, 04 Авг. 18, 09:15очень люблю смотреть их ролики!иногда складывается впечатление, что мы как туземцы, вообще них..я не знаем.
Вот, получается, что перегрев и перенасыщение - причина, кипение и конденсация- следствия.
Отв.449 04 Авг. 18, 10:07 (через 5 мин)
В пленочном СКОРЕЕ ВСЕГО не кипит, т.к. очень сложно возниунуть условиям кипения.
В эмульгационном то же НЕ ФАКТ что кипит, но предположить наличие кипения здесь гораздо проще.Kotische, 04 Авг. 18, 09:04
КИПИТ - и в первом, и во втором случаях при нормальном режиме (рабочем режиме - режиме получения необходимого продукта на выходе колонны).
Скрытый текст
Как уже было мной рассказано выше
кипение жидкости - это предельное по своей интенсивности испарение жидкого вещества, происходящее при высшей температуре испарения этого вещества в данных условиях(атмосферном давлении внутри испаряющей системы).
При этом кипение жидкости происходит гораздо более интенсивно, чем обычное (не предельное - не равное кипению) испарение с поверхности, из-за:
- подведения такого количества тепловой энергии, какого достаточно для разрыва водородных связей между соседними молекулами по всему объему жидкости, а не только на поверхности этой жидкости
- присутствия очагов парообразования (полного разрыва связей между соседствующими молекулами) во всем объеме жидкости, обусловленных как более значительной величиной подводимой тепловой энергии для процесса кипения, так и наличием примесей (разнородных веществ) в составе этой жидкости, выступающих "центрами локального парообразования" по всему объему этой жидкости.ВМБ, 25 Июля 18, 22:35
При кипении жидкости её температура остается неизменной для данных условий её нахождения.
Кипение жидкости - это состояние жидкости, когда вся подводимая из-вне энергия идёт не на повышение температуры этой жидкости (повышение кинетической энергии движения молекул жидкости связанных между собой водородными межмолекулярными связями), а сугубо на разрыв этих связей - на переход молекул жидкости из связанного состояния в свободное от этих связей состояние - переход из одного агрегатного состояния (жидкого) в другое (газообразное - пар).
Энергия, необходимая для перехода жидкости из жидкого состояния в газообразное, значительно превышает энергию, необходимую для нагревания ее до температуры кипения.
Например, для плавления 1 кг льда температурой 0°С требуется 340 кДж энергии. Для нагревания полученной воды массой 1 кг от 0°С до 100°С необходимо уже 420 кДж. А для того, что бы обратить эту воду в 1 кг пара с температурой, равной тем же 100°С требуется 2260 кДж энергии! Такой же объем энергии - 2260 кДж - выделяется при конденсации 1 кг пара температурой 100°С в 1 кг жидкой воды с той же температурой 100°С.
Таким образом, для нагрева 1 кг воды от 0°С до 100°С в нормальных условиях (при нормальном атмосферном давлении) до состояния кипения - состояния при котором по всему объему воды начинает происходить разрыв межмолекулярных связей - достаточно всего лишь 0,2 кг водяного пара.
Внутри колонн стекающая вниз от дефлегматора (источника конденсации части достигшего его пара - источника превращения части этого пара во флегму - в жидкость) флегма находится не в виде цельных макрообъемов (типа 10 литров или хотя бы 1 литра - 100 мм*100мм*100мм)а в виде разрозненных между собой миниобъемов жидкости - множества ручейков и капель малого (несколько миллиметров, массой не более 1-2 грамм даже для крупных - заводских колонн) диаметра.
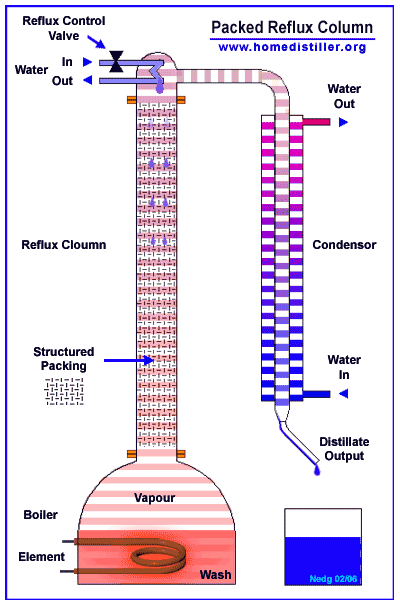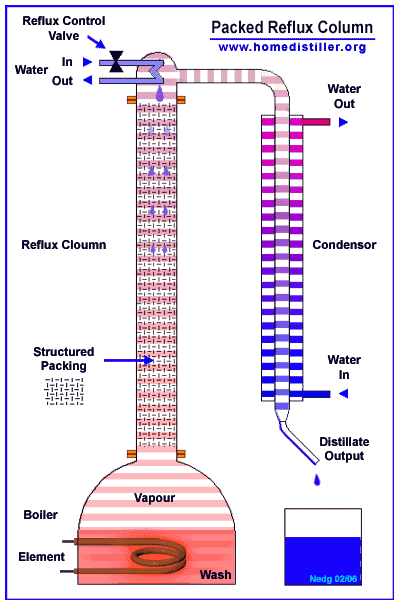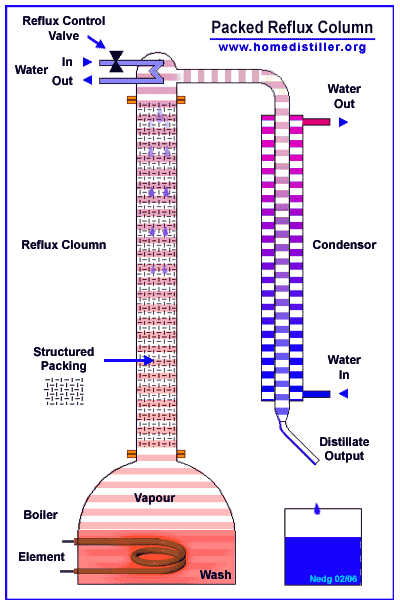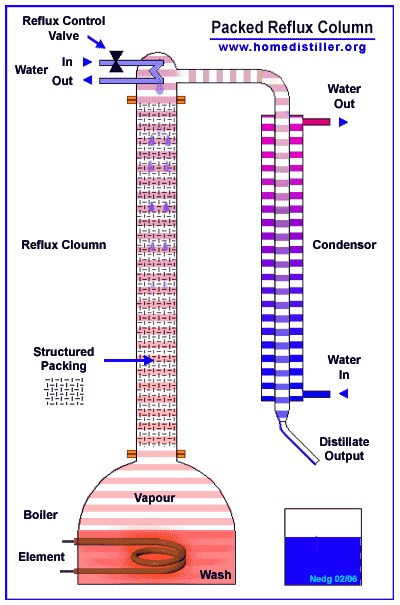
Эти сконденсировавшиеся из пара ручейки и капли имеют предельную для данного уровня колонны температуру - температуру очень близкую к температуре кипения этой смеси (смеси воды и спирта) в данных условиях.
При встрече этой ниспадающей сверху вниз флегмы с восходящими снизу вверх парами эта флегма почти моментально (доли секунды) прогревается избыточной энергией от конденсации соприкасающегося с ней пара и начинает кипеть - выделять из всего своего объема те молекулы, какие имеют самые слабые водородные связи (в основном молекулы спирта), конденсируя при этом в жидкость молекулы с наиболее сильными водородными связями (молекулы воды).
В результате этого постоянно идущего по всей высоте колонны на каждом её уровне процесса конденсации-парообразования жидкая часть (флегма) постоянно обедняется (в результате своего кипения) своей легкокипящей фракцией (молекулами спирта) и всё более насыщается (в результате конденсации при соприкосновении с ней восходящих из куба паров)труднокипящей фракцией (молекулами воды).
Именно так происходит процесс кипения-конденсации по всей высоте любой нормально работающей колонны.
Далее под значком "Скрытый текст" - ранее удаленный игорем 233 мой пост для новичков форума и всех интересующихся физикой процессов - чтобы они смогли ясно и чётко представлять откуда что берётся и куда что девается и почему.
Итак, продолжаем.
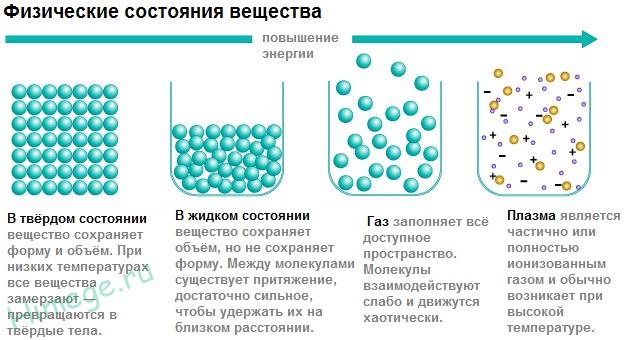
Существует три основных агрегатных состояния вещества: твёрдое тело, жидкость и газ. К агрегатным состояниям также часто относят плазму (полностью или частично ионизированный газ, возникающий при очень высокой температуре).
Твёрдое тело - это такое состояние вещества, которое характеризуется способностью сохранять объём и форму. Атомы и молекулы твёрдого тела совершают лишь небольшие колебания вокруг состояния равновесия. Присутствует как дальний, так и ближний порядок. В твердом состоянии атомы или молекулы вещества имеют самые прочные водородные связи. Так, например, вода в твердом состоянии является льдом. Во льду каждая молекула Н2O окружена четырьмя ближайшими к ней молекулами, находящимися на одинаковых расстояниях от неё, равных 2,76 Å и размещённых в вершинах правильного тетраэдра. Ибо каждая молекула воды может образует до четырёх водородных связей — две из них образует атом кислорода и две — атомы водорода. В твердом состоянии (состоянии льда) благодаря этим четырём водородным связям каждая молекула воды и объединяется с четырьмя соседними молекулами в жесткую пространственную структуру - кристаллы льда в виде правильных тетраэдров. Данное возможное количество водородных связей (четыре) у воды и их разветвлённая структура определяют высокую температуру кипения воды и её удельную теплоту парообразования. Если бы у воды не было этих водородных связей, то вода, на основании места кислорода в таблице Менделеева и температур кипения гидридов аналогичных кислороду элементов (серы, селена, теллура), кипела бы при −80 °С, а замерзала при −100 °С.
Жидкость - это такое состояние вещества, при котором оно обладает малой сжимаемостью, то есть хорошо сохраняет объём, однако не способно сохранять форму, ибо в жидком состоянии молекулы вещества используют не все возможные для них водородные связи с соседними молекулами, а только часть из них. Например, молекулы вода в жидком состоянии используют лишь 3, а при высоких температурах (близких к кипению) 2 и даже порой 1 водородную связь. Из-за такого неполного использования молекулами жидкости своих возможных водородных связей жидкость теряет кристаллическую структуру твердого вещества и приобретает текучесть - легко принимает форму сосуда, в который она помещена. Атомы или молекулы жидкости используя лишь часть своих возможных водородных связей совершают довольно значительные (по сравнению с поведением этих атомов и молекул в состоянии твердого тела) колебания вблизи состояния равновесия, ограниченного соседними атомами или молекулами, но из-за неиспользования всех возможных водородных связей часто перескакивают на другие свободные места. У жидкости присутствует только ближний порядок объемного расположения молекул или атомов.
Газ - это такое состояние вещества, которое характеризуется хорошей сжимаемостью, отсутствием способности сохранять как объём, так и форму. Газ стремится занять весь объём, ему предоставленный. Атомы или молекулы газа ведут себя довольно свободно, потому как между молекулами или атомами газа (в том числе и пара, включая и рассматриваемую ниже смесь спирто-водяных паров) НЕТ ВОДОРОДНЫХ СВЯЗЕЙ, отчего расстояния между молекулами или атомами газа даже в герметически закрытом сосуде гораздо больше их размеров и расстояний между этими же молекулами или атомами в жидком либо твердом состоянии данного вещества.

Вода существует в интервале температур от 0 °С до 100 °С, лед — при температуре ниже 0 °С. При температуре выше 100 ºС и нормальном атмосферном давлении молекулы воды существуют только в газообразном состоянии — в виде водяного пара. Вода, лед и водяной пар — это одно и то же вещество с химической формулой Н2О.
В русле рассматриваемого в теме вопроса - "что происходит в колонне при перегонке кубовой навалки" - нас будет интересовать лишь два из вышеперечисленных агрегатных состояний - спирто-водяная жидкость и спирто-водяной пар (спирто-водяной газ).
Переход вещества из жидкого состояния в газообразное называется парообразованием, а вот обратный процесс - переход вещества из парообразного (газового) состояния в жидкое - называется конденсацией. Пример парообразования — испарение воды, обратный процесс можно наблюдать при выпадении росы или при конденсации спирто-водных паров в стеклянном холодильнике дистилляционной установки.
Как уже было мной рассказано пару дней назад выше (в предыдущем моём сообщении в теме), для жидкостей существуют два вида парообразования – два вида процесса перехода вещества из жидкого состояния в газообразное состояние: испарение и кипение.
При этом испарение жидкости отличается от кипения жидкости тем, что:
испарение жидкости — это процесс перехода жидкости в пар, происходящий в широком интервале температур и давлений только на поверхности данной жидкости, а вот кипение жидкости - это интенсивный переход жидкости в пар, происходящий при определенной и неизменной (для определенного давления) температуре по всему объему данной жидкости.
Как уже было мной сказано выше, температура системы и тепловая энергия системы - это две совершенно разные физические сущности.
Температу́ра (от лат. temperatura — надлежащее смешение, нормальное состояние) — это сугубо эмпирическая (условно принятая опытным образом) физическая величина, характеризующая термодинамическую систему и количественно выражающая интуитивное понятие о различной степени нагретости тел (о степени удельной тепловой энергии с аккумулированной данным телом).
Точное определение температуры - степени нагретости тел - требует, чтобы температура измерялась объективно, с помощью приборов. Такие приборы называются термометрами и измеряют так называемую эмпирическую температуру. В эмпирической шкале температур устанавливаются две реперные (исходные) точки и число делений между ними — так были введены используемые ныне шкалы Цельсия, Фаренгейта и другие. В частности в шкале температур Цельсия за одну исходную точку (0°C)- принята температура таяния водяного льда, а за другую (100°C) - температура кипения воды. Не вода кипит при 100°C, а именно эмпирическая термометрическая величина в 100°C по шкале Цельсия - принята за исходную точку кипения чистой природной воды при нормальном атмосферном давлении (1 атм - 101 кПа.). . А вот по шкале Фаренгейта температура таяния льда равна +32 °F, а температура кипения воды равна +212 °F (при нормальном атмосферном давлении). При этом один градус Фаренгейта равен 1/180 разности этих температур (212-32 = 180). При этом диапазон от 0°F … до +100 °F по шкале Фаренгейта примерно соответствует диапазону -17,8…+37,8 °C по шкале Цельсия. Ибо по одной (наиболее достоверной) из версий, польско-немецкий физик Даниель Габриель Фаренгейт изначально принял за 0 °F наименьшую температуру на улице, какую смог найти (зимой 1708 — 1709 годов), а за 100 °F — температуру своего тела (при этом будучи на основательном "сугреве" шнапсом - чтобы не замерзнуть в поисках места с самой низкой температурой на улице города). Такая вот шкала температур у этой самой шкалы Фаренгейта.
Как видите шведский учёный Андерс Цельсий, предложивший в 1742 году уже свою шкалу температур, отнёсся к созданию этой шкалы и особенно к определению двух её базовых точек намного более основательнее и серьёзнее с научной точки зрения чем Даниель Фаренгейт.
Из-за того, что температура — это эмпирическая физическая величина фиксирующая меру (удельную величину) тепловой энергии тела - удельную величину кинетической энергии молекул данного тела, наиболее естественно было бы измерять её именно в энергетических единицах (например, в системе СИ в джоулях; или электрон-вольтах для микро-энергетических уровней атомов и молекул вещества - эВ). Однако, как было рассказано выше, практическое измерение температуры (создание той или иной шкалы температуры и на основании этой шкалы массовое изготовление термометров с этой шкалой)началось задолго до создания молекулярно-кинетической теории, в связи с чем практические шкалы измеряют температуру в условных единицах — градусах.
В свою очередь, теплова́я эне́ргия — это форма энергии, связанная с движением атомов, молекул или других частиц, из которых состоит тело. По своей физической сути, тепловая энергия — это суммарная кинетическая энергия структурных элементов вещества (будь то атомы, молекулы или заряженные частицы). Тепловая энергия системы плюс потенциальная энергия межатомных взаимодействий называется внутренней энергией системы. Теплова́я эне́ргия измеряется в джоулях - Дж (в СИ).
Любое тело (твёрдое, жидкое или даже газообразное) состоит из атомов и молекул, и тепловая энергия этого тела - его внутренняя внутренняя энергия обусловлена движением (колебаниями) атомов и молекул этого тела и рассматривается как следствие теплового движения этих частиц, а абсолютная температура тела прямо пропорциональна средней кинетической энергии такого движения атомов и молекул. Коэффициент пропорциональности — постоянная Больцмана. Постоя́нная Бо́льцмана ( k {\displaystyle k} k или k B {\displaystyle k_{\rm {B}}} k_{{{\rm {B}}}}) — физическая постоянная, определяющая связь между температурой и энергией. Названа в честь австрийского физика Людвига Больцмана, сделавшего большой вклад в статистическую физику, в которой эта постоянная играет ключевую роль. Её экспериментальное значение в Международной системе единиц (СИ) равно: k = 1,380 648 52 X·10−23 Дж/К. XXIV Генеральная конференция по мерам и весам, состоявшаяся 17—21 октября 2011 года, приняла резолюцию, в которой, в частности, предложено будущую ревизию Международной системы единиц произвести так, чтобы зафиксировать значение постоянной Больцмана, после чего она будет считаться определённой точно. В результате будет выполняться точное равенство k = 1,380 6X·10−23 Дж/К, где Х заменяет одну или более значащих цифр, которые будут определены в дальнейшем на основании наиболее точных рекомендаций CODATA. Такая предполагаемая фиксация связана со стремлением переопределить единицу термодинамической температуры кельвин, связав его величину со значением постоянной Больцмана. Кельвин - это единица термодинамической температуры в Международной системе единиц (СИ), одна из семи основных единиц СИ. Предложена в 1848 году. Один кельвин равен 1/273,16 части термодинамической температуры тройной точки воды. Начало шкалы (0 К) совпадает с абсолютным нулём. Пересчёт в градусы Цельсия:
t C = t K − 273 , 15 (температура тройной точки воды +0,01 °C).
Сугубо физически за 0 градусов Кельвина принято состояние тела при котором все его атомы или молекулы находятся в состоянии полного покоя - не совершают никаких движений (колебаний) относительно соседних молекул или атомов (кинетическая энергия всех молекул данного тела равна 0).
Молекулы любой жидкости находятся в непрерывном и беспорядочном движении (в пространственном колебании – колебании в трёх направлениях – вверх-вниз, лево-право, вперёд-назад)относительно окружающих их молекул данной жидкости. Причем, чем выше температура жидкости, тем больше кинетическая энергия молекул, а потому и больше интенсивность (размах и частота) их пространственных колебаний. Среднее значение кинетической энергии имеет определенную величину. Но у каждой молекулы кинетическая энергия может быть как больше, так и меньше средней. Если вблизи поверхности окажется молекула с кинетической энергией, достаточной для преодоления сил межмолекулярного притяжения, она вылетит из жидкости. То же самое повторится с другой быстрой молекулой, со второй, третьей и т. д. Вылетая наружу, эти молекулы образуют над жидкостью пар.
В отличие от кипения жидкости, испарение жидкости происходит при любой температуре данной жидкости. Однако с повышением температуры жидкости (т.е. внутренней тепловой энергии жидкости - кинетической энергии движения молекул данной жидкости) скорость испарения возрастает (ибо чем больше внутренняя тепловая энергия этой жидкости - тем меньше водородных связей имеется между её молекулами или атомами). Чем выше температура жидкости, тем больше быстро движущихся молекул имеет достаточную кинетическую энергию, чтобы преодолеть силы притяжения соседних частиц – разорвать водородные связи между молекулами, стать свободными, пробиться ("растолкав" другие молекулы) к поверхности жидкости - и вылететь за пределы этой жидкости, тем быстрее идет испарение.
С тепловой энергией тела (внутренней кинетической энергией его молекул или атомов) тесно связана такая физическая величина как удельная теплоёмкость тела. Удельная теплоёмкость тела — это физическая величина, равная численно количеству теплоты, которое необходимо передать единице массе данного вещества для того, чтобы его температура изменилась на единицу (на один градус теплоты по шкале Цельсия или шкале Кельвина). В системе единиц (СИ) удельная теплоёмкость обозначается в джоулях на килограмм на кельвин, Дж/(кг·К).
Формула расчёта удельной теплоёмкости:
где c — удельная теплоёмкость,
Q — количество теплоты, полученное веществом при нагреве (или выделившееся при охлаждении),
m — масса нагреваемого (охлаждающегося) вещества,
ΔT — разность конечной и начальной температур вещества.
Удельная теплоёмкость — это физическая величина, равная численно количеству теплоты, которое необходимо передать единице массе данного вещества для того, чтобы его температура изменилась на единицу. В системе единиц (СИ) удельная теплоёмкость обозначается в джоулях на килограмм на кельвин, Дж/(кг·К)
Например для воды, при температуре 20 градусов Цельсия и нормальном атмосферном давлении удельная теплоемкость воды равна 4183 Дж/(кг·град)= 4,183 кДж/(кг·град). а при температуре 100°С эта величина достигает значения 4220 Дж/(кг·град).
А вот для этанола (этилового спирта) удельная тепрлоёмкость равна 2,438 Дж/(кг·град)
При этом для стали (в том числе и для "нержавейки"Подмигивающий удельная теплоёмкость = 0,462 Дж/(кг·град), а для меди = 0,385 Дж/(кг·град).
Таким образом, для нагрева 1 кг воды от 20 градусов Цельсия до 100 градусов Цельсия (дол температуры кипения) требуется передать этому 1 кг воды тепловую энергию в объеме 4,183 кДж/(кг·град) * (100-20)(кг·град) = 4,183 кДж/(кг·град) *80(кг·град) = 334,64 кДж.
В свою очередь существует и такая физическая величина как удельная теплота парообразования жидкости (удельная теплота кипения жидкости). Уде́льная теплота́ парообразова́ния (равна по величине удельной теплоте конденса́ции но с обратным знаком) — физическая величина, показывающая, какое количество теплоты необходимо, чтобы обратить количество жидкости с единичной массой в пар , при данной температуре жидкости и без её изменения (температуры) в процессе испарения. Равна удельной теплоте конденсации единичной массы пара в жидкость.
Так, удельная теплота кипения воды или парообразования – это физическая величина, отражающая количество теплоты, необходимое для превращения 1 л кипящей воды в пар.
Процесс кипения воды, как и любого другого вещества, происходит с поглощением теплоты (подводимой тепловой энергии). Значительная часть подводимой теплоты необходима для разрыва связей между молекулами воды - разрыва водородных связей между водными молекулами. Другая часть подводимой тепловой энергии расходуется на процессы, происходящие при образовании и расширении пара (водяного газа)у поверхности или во всем объеме воды.
Единица удельной теплоты парообразования в системе СИ: [ L] = 1 Дж/кг.
Удельная теплота испарения воды равна 2260 кДж/кг. - это энергия необходимая для того, чтобы у 1 кг нагретой до 100 °C воды разорвать все водородные связи между молекулами и превратить их в водяной пар массой 1 кг с температурой в 100 °C.
При кипении температура воды не повышается потому как тепловая энергия системы (например, 1 кг жидкой воды нагретой до 100 °C) уже достигла своего максимума (кинетическая энергия молекул жидкости - размах и частота колебаний молекул - уже предельна и не увеличивается). И потому вся подводимая к этой системе энергия (превышающая энергию, необходимую для нагрева 1 кг воды до 100°C) расходуется исключительно на разрыв водородных связей между молекулами жидкой воды и превращению её в пар (газ) у молекул какого отсутствуют связи между друг другом.
Как видите эта энергия (энергия необходимая для преобразования 1 кг жидкой воды нагретой до 100 °C в 1 кг водяного пара с такой же температурой в 100 °C.) больше энергии необходимой на нагрев этого же 1 кг воды от 20°C. до 100 °C. почти в 7 раз = 2260 кДж/кг /334,64 кДж = 6,7535 раза.
Как известно большинству участников темы из курса школьной физики 1 кВт·ч = 3600 кДж. А потому в привычных для большинства участников темы единицах измерения электроэнергии потребуется энергии для:
- нагрева 1 кг воды от 20°C. до 100 °C = 334,64 кДж/ 3600 = 0,093 кВт;
- полного испарения этого 1 кг воды нагретой до 100°C = 2260 кДж/3600= 0,628 кВт·ч.
Итого на нагрев от от 20°C. до 100 °C и полное испарение 1 кг воды потребуется 0,093 кВт + 0,628 кВт·ч = 0,721 кВт·ч. Даже если тепловые потери (рассеивание тепла кубом и колонной до холодильника) составят 15%, то необходимое количество энергии требуемое практически для нагрева и испарения 1 кг воды не превысит 0,721 кВт·ч * 1,15 = 0,83 кВт·ч.
Таким образом при мощности ТЭНа в кубе равной 2 кВт каждый час из куба+колонна будет испаряться (а затем конденсироваться в холодильнике установки) порядка 2/0,83 = 2,4 кг воды.
Но мы же работает не с чистой водой, а со спирто-водной смесью (будь то брага или спирт-сырец) различной крепости. А у такой смеси и и удельная теплоемкость и теплота парообразования существенно ниже чем у чистой воды. Поэтому, например, для кубовой навалки состоящей из спирта-сырца 35% крепости по объему ТЭНа мощностью в 2 кВт достаточно чтобы выпарить и сконденсировать в холодильнике за час около 3 кг спирто-водной смеси крепостью уже 70% объемных (3,5-3,7 литра такой смеси).
Вот эти вышеизложенные факторы и величины и будут лежать в основе описания физических процессов при перегонке кубовой навалки на колонне - описании того, как и почему на каждом уровне колонны именно кипит (разогреваясь до соответствующей данной её крепости по спирту температуры кипения) ниспадающая вниз от дефлегматора флегма, разогреваемая до кипения паром водно-спиртовой смеси, встречно поднимающимся снизу колонны (напрямую соединенной с кипящей в кубе навалкой)вверх на встречу этой флегме.
Само же описание этого сугубо частного процесса (и исправление в отображении формул в сообщении - не перенеслись как положено) дам уже завтра в этом же сообщении - потому как за два дня устал сильно и спать хочу жутко - в поездке по делам почти не спал двое суток.
ибо нефиг десятистраничные тексты постить.
Котище.
Спасибо, Kotische , потому как еще не знаю, как прятать под спойлер тексты на форуме. :)
okun
пользователь
Тольятти
6.8K 2.5K 3


Отв.450 04 Авг. 18, 10:21 (через 14 мин)
замечу, что своими глазами видел как в стеклянной колбе с откаченным воздухом происходило кипение воды, но при этом пара небыло.mekkaod, 04 Авг. 18, 09:42
Пар был, но ты его не видел. Эффект суслика.
ВОблин
Доцент
Самара
1.9K 672


Отв.451 04 Авг. 18, 10:21 (через 1 мин)
ВМБ, вот ведь можешь нормально разговаривать, что выеб...ся, спрашивается!?
Все это не интересно, ибо так процесс можно описать школьникам. А здесь дяди большие, википедии недостаточно.
Все это не интересно, ибо так процесс можно описать школьникам. А здесь дяди большие, википедии недостаточно.
Таким образом, для нагрева 1 кг воды от 0°С до 100°С в нормальных условиях (при нормальном атмосферном давлении) до состояния кипения - состояния при котором по всему объему воды начинает происходить разрыв межмолекулярных связей - достаточно всего лишь 0,2 кг водяного пара.ВМБ, 04 Авг. 18, 10:07пар какой температуры?
(доли секунды)ВМБ, 04 Авг. 18, 10:07для чего колонне развитая поверхность и гидродинамика насадки?
Kotische
Академик
Саратов
8.2K 2.6K


 Отв.452 04 Авг. 18, 10:26 (через 5 мин)
Отв.452 04 Авг. 18, 10:26 (через 5 мин)
КИПИТ - и в первом, и во втором случаях при нормальном режимВМБ, 04 Авг. 18, 10:07Как же тяжело общаться с Буратиной! >:(
Выше приводили скан из НОРМАЛЬНОГО учебника, а не из поделия эпохи ЕГЭ.
Кипение это образоварие пузырей ВНУТРИ объема жидкости. При этом СОЗДАЕТСЯ ГРАНИЦА РАЗДЕЛА ФАЗ ВНУТРИ жидкости. Именно СОЗДАЕТСЯ!!!
И температура кипения - это НЕ КОНСТАНТА а ФУНКЦИОНАЛЬНАЯ ЗАВИСИМОСТЬ.
Константой является темперетура фазового равновесия.
А температура кипения ЗАВИСИТ от количества теплоты передаваемого жидкости и способности жидкости сбрасывать излишки энергии в фазовый переход.
okun
пользователь
Тольятти
6.8K 2.5K 3


Отв.453 04 Авг. 18, 10:28 (через 2 мин)
Вот, получается, что перегрев и перенасыщение - причина, кипение и конденсация- следствия.ВОблин, 04 Авг. 18, 10:03
Не получается... Пазл не складывается... Если внимательно посмотреть ролик, получается что перегрев и перенасыщение не являются причиной кипения и конденсации.
Kotische
Академик
Саратов
8.2K 2.6K


 Отв.454 04 Авг. 18, 10:33 (через 6 мин)
Отв.454 04 Авг. 18, 10:33 (через 6 мин)
Причиной является наличие ЦЕНТРОВ КИПЕНИЯ и ЦЕНТРОВ КОНДЕНСАЦИИ
ВОблин
Доцент
Самара
1.9K 672


Отв.455 04 Авг. 18, 10:34 (через 1 мин)
okun, ну, как не получается!? Двадцать страниц об этом с разных сторон говорим! Леш, ты что, тупо тролишь чтоль?
Добавлено через 1мин.:
Добавлено через 1мин.:
Причиной является наличие ЦЕНТРОВ КИПЕНИЯ и ЦЕНТРОВ КОНДЕНСАЦИИKotische, 04 Авг. 18, 10:33но без перегрева и переохлаждения, даже при наличии центров конденсации и парообразования, ни конденсация ни кипение не начнется.
Kotische
Академик
Саратов
8.2K 2.6K


 Отв.456 04 Авг. 18, 10:37 (через 3 мин)
Отв.456 04 Авг. 18, 10:37 (через 3 мин)
без перегрева и переохлажденияВОблин, 04 Авг. 18, 10:34Необходимое но не достаточное условие.
ВОблин
Доцент
Самара
1.9K 672


Отв.457 04 Авг. 18, 10:38 (через 2 мин)
Необходимое но не достаточное условие.Kotische, 04 Авг. 18, 10:37базовое.
Kotische
Академик
Саратов
8.2K 2.6K


 Отв.458 04 Авг. 18, 10:43 (через 6 мин)
Отв.458 04 Авг. 18, 10:43 (через 6 мин)
Степень перегрева - есть функциональная зависимость от концентрации центров кипения и потока энергии.
Добавлено через 6мин.:
Добавлено через 6мин.:
как прятать под спойлер тексты на форумВМБ, 04 Авг. 18, 10:07Тегом "hide"
ВОблин
Доцент
Самара
1.9K 672


Отв.459 04 Авг. 18, 11:06 (через 23 мин)
Степень перегрева - есть функциональная зависимость от концентрации центров кипения и потока энергии.Kotische, 04 Авг. 18, 10:43
конечно же я имею ввиду поток энергии. он же базовый или нет?
